Bielkoviny, jeden zo štyroch základných bioelementov bunky, bielkoviny, nukleové kyseliny, sacharidy a tuky. Bielkoviny plnia v organizme mnohoraké úlohy a to vďaka premyslenému systému kódovania, z ktorého vyplýva, že existuje množstvo bielkovín skladajúcich sa z 20 aminokyselín a odlišujúcich sa primárnou, sekundárnou, terciárnou a kvartérnou štruktúrou. To má za následok mnohoraké funkcie. Pochopeniu funkcii vyplývajúcich z štruktúry nám pomôže poodhaliť, okrem iného, príčiny a spôsoby liečby niektorých ochorení.
Úvodom do biochémie
Bielkoviny sú kódované tripletmi (kodónmi, sekvencia 3 nukleotidov) nachádzajúce sa na informačnej mRNA, ktorá vzniká v procese transkripcie z DNA. V procese translácie sa na ribozómoch syntetizuje bielkovina z α-aminokyselín (ďalej AK). Na informačnú mRNA sa komplementárne naviaže transportná tRNA s antikodónom (komplementárne zapadá do kodónu mRNA), nesúca určitú AK do polymerizačnej reakcie vznikajúceho proteínu. Deje sa to na ribozómoch pričom sa AK spájajú peptidovými väzbami. V princípe triplety determinujú konkrétne AK a tým stoja za vznikom genetického kódu. Na ňom zase stojí a padá genetika. Preto len malá zmena v triplete môže do bielkoviny zaradiť inú AK a tým spôsobiť ochorenie, napríklad kosáčikovitú anémiu.
Poradie AK v bielkovine tvorí primárnu štruktúru, ktorá z funkčného hľadiska determinuje ďalšie konformácie a tým aj konečný tvar, funkciu v bunke a jej celkovú stabilizáciu. Kým primárna štruktúra je postavená na pevných kovalentných väzbách, v ostatných zohrávajú dôležitú úlohu energeticky slabé interakcie ako vodíkové mostíky, Van der Waalsové a disulfidové väzby, hydrofóbne a hydrofilné interakcie. Tieto interakcie poskytujú hlavne postranné reťazce AK, tie sú nositeľmi určitých elektrochemických vlastností každej AK. Postranné reťazce môžu byť kyslé, bázické, alifatické, aromatické, obsahujúce –OH alebo –SH skupinu. Tieto postranné skupiny sú dôležité až pri terciárnej štruktúre, ktorú opíšem neskôr. Chrbticu bielkovín tvoria práve vodíkové mostíky a nie medzi postrannými reťazcami ale medzi karbonylovým kyslíkom a vodíkom aminoskupiny obsiahnutých v peptidovej väzbe.
Tá chrbtica je prvá dôležitá stabilizácia bielkoviny ako priestorové usporiadanie primárneho poradia AK do priestorovej štruktúry: α-helix, β-skladaný list a β-ohyb, tj. sekundárna štruktúra. Pri tomto usporiadaní postranné reťazce vytŕčajú do priestoru, kolmo na os helixu. Konkrétne, α-helix je pravotočivá špirála vznikajúca vodíkovým spojením karbonylovej skupiny jednej AK a aminovej skupiny s vodíkom predchádzajúcej štvrtej AK v jednej časti reťazca. Tieto mostíky sú rovnobežné s osou helixu. Ak sa v sekvencii nachádzajú AK prolín, glycín a tyronín nastáva porušenie helixu, tieto AK sa nedokážu zaradiť do závitnice. β-ohyb vzniká vodikovým mostíkom medzi karbonylovým uhlíkom jednej AK a amidovým vodíkom tretej AK. Je to vlastne otočenie bielkovinového reťazca o 180°. Dosiahnu sa tak dva paralelné časti reťazca, ktoré sa zase môžu navzájom spojiť medzi kyslíkom a vodíkom obdobne ako pri predchádzajúcich štruktúrach. Takto sa vytvára štruktúra β-skladaného listu. Tieto usporiadania výrazne stabilizujú bielkovinu, pretože vodíkové mostíky patria medzi najsilnejšie slabé interakcie.
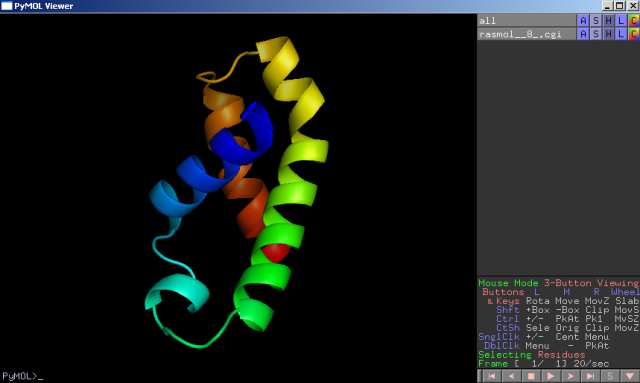
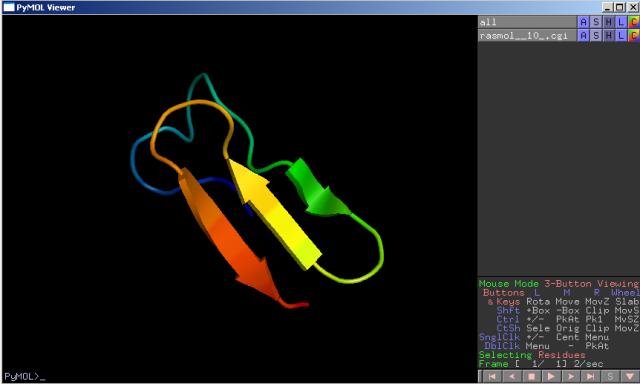
Pri vyššom stupni usporiadanosti hrajú dôležitú úlohu už spomínané postranné reťazce AK. Základný reťazec pozostávajúci z α a β štruktúr sa ďalej v priestore formuje a vytvára konečnú fibrilárnu (vláknitú) alebo globulárnu (klbkovitú) formu bielkoviny nazývaná ako terciárna štruktúra. Postranné reťazce sa vo vodnom prostredí na základe elektrochemických silových pôsobení interagujú s cieľom vytvoriť nízkoenergetickú a stabilnú formu. To znamená použitie čo najväčšieho množstva energie na denaturáciu, rozrušenie, bielkoviny. Pritom druhé výrazné zníženie vnútornej energie predstavuje natočenie hydrofóbnych častí proteínu "dovnútra" a hydrofilnych častí "vonku" do vodného prostredia. Posledná priestorová organizácia bielkoviny je, že sa jednotlivé reťazce môžu spájať ako podjednotky do zložitejších komplexov dvoch a viacerých proteínov, takzvanej kvartérnej štruktúry. Napríklad inzulín pozostáva z A-reťazca (21 AK) a B-reťazca (30 AK) alebo hemoglobín sa skladá z dvoch α a dvoch β podjednotiek.
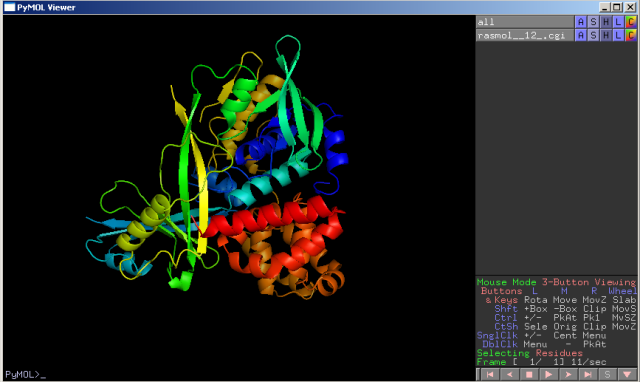
Tieto popísané štruktúry determinujú určité funkčné vlastnosti bielkoviny na základe fyzikálnych a chemických vlastností priestorového usporiadania reťazca. Medzi fyzikálne patrí napríklad aj rozpustnosť. Fibrilárne bielkoviny sú vo vode nerozpustné a plnia najmä mechanickú funkciu, keratín (nechty, vlasy), kolagén (chrupavky, šľachy), fibrín (hemokoagulácia), aktín, myozín a tropomyozín (svaly). Globulárne bielkoviny sú vo vode rozpustné a preto sú aj dôležité pri energetickom metabolizme bunky ako enzýmy (70% objemu tela tvorí vodné prostredie). Iné funkcie proteínov: transportná (hemoglobín) stavebná a transportná (membránové bielkoviny) signálna (hormóny a receptory) obranná (globulíny) osmotická (albumíny), katalytická (enzýmy) funkcia, atď. Chemické vlastnosti určujú takzvané aktívne miesta (miesto) proteínu, vpodstate určuje spôsob interakcie s inými molekulami a iónmi. Toto miesto sa vyskytuje pri enzýmoch. Je to špecifické poradie AK, odhalené miesto ostatnými časťami bielkoviny aby bol možný prístup, napríklad, substrátu. Určité sekvencie AK môžu viazať ióny alebo nízkomolekulové látky (napr. vitamíny) ako kofaktory enzýmov alebo pre iný špecifický účel. Napríklad v hemoglobíne je naviazaný ión Fe2+, alebo relaxačná bielkovina torponín má aktívne miesto pre Ca2+ a následnou zmenou konformácie tropomyozínu umožní sťah svalu.
Medzi najdôležitejšie proteíny patria práve enzýmy. Majú úlohu takzvaných biokatalyzátorov. To znamená, že urýchľujú chemické reakcie v bunke, ktoré by za normálnych okolnosti buď neprebiehali vôbec alebo veľmi pomaly, pričom z reakcie vychádzajú v nezmenenej forme. Môžu pôsobiť pri katabolických procesoch (rozkladných, štiepenie polymérov a jednoduchých molekúl pri uvoľnení energie) alebo anabolicky (tvorba polymérov a jednoduchých molekúl za dodanie energie). Umožňujú normálny chod bunky od reparačných mechanizmov, tvorby bunečných štruktúr, až po uvoľňovanie energie pri metabolizme a rozklad štruktúr v bunke. Na ich správnom fungovaní závisí životaschopnosť bunky. Práve poznanie funkčných vlastností enzýmov a poznanie ich "pohybovej" aktivity, teda poznanie postupnosti chemických reakcii krok po kroku (reparácia DNA) nám uľahčí objavenie liekov na mnohé choroby. Umožní nám to vytvoriť liek na mieru. Musíme byť schopný určiť funkciu a spôsob fungovania na základe poznania poradia aminokyselín v reťazci.
Simulácia, počítačová hra vedcov
Aj tie najjednoduchšie chemické procesy v tele sú strašne zložité a nie to ešte niečo ako napríklad reparácia DNA DNA-polymerázou. Tento enzým (aj s pomocou iných enzýmov) umožňuje opraviť poškodenú DNA, znovu nasyntetizovať správnu sekvenciu nukleotidov a tým napríklad opraviť alebo obnoviť tvorbu dôležitého proteínu, ktorý tam bol pôvodne kódovaný. V tom najhoršom prípade poruchy tohto enzýmu sa môže stať, že takto poškodená, neopravená DNA, nebude produkovať dôležité látky (regulačné proteíny) a takto poškodená bunka sa bude neobmedzene množiť (bez adhéznej aktivácie a kontaktnej inhibície). Môže pritom vytvárať benígne (nezhubne) alebo malígne (zhubne) nádory ohrozujúce život človeka.
Však viete ako rakovina dokáže strpčiť život a určite chápete úsilie ju liečiť bez drastických liečebných postupov akou je chemoterapia a ožarovanie. Môžem s čistým svedomím povedať, že rakovinové bunky doslova vyciciavajú život zo zdravých buniek, sú nenásytné a pažravé po energii (výživných látok) pre svoj nekontrolovateľný rast. Tu nám prichádza na pomoc počítačová simulácia. Práve ona nám dokáže objasniť prirodzené reparačné procesy, ktoré môžeme využiť pri tvorbe liekov, prakticky umelo pripravených účinných reparačných enzýmov.
Tieto reparačné enzýmy sú veľmi zložité komplexy. Ich úlohou je skenovať DNA, nájsť poškodené miesto, opraviť ho a znovu preventívne pokračovať v skenovaní. Problém nastáva pri otázkach: Ako to funguje? Akým spôsobom deteguje porušenie, aké aktívne miesta enzýmu sú pri tom dôležité, ako sa pohybuje po molekule DNA, ako prinesie nukleotid na opravu, na akej časti a ako je prichytený, ako sa zabezpečí naviazanie DNA a nukleotidu, ako sa zabezpečí dodanie energie, atď. Vidíte, že to vôbec nie je jednoduché. Všetky tieto interakcie ako detegovanie, naviazanie, prinesenie a opravenie priamo závisia od štruktúry proteínu. Práve tej štruktúry, ktorá je opisovaná v prvej časti článku. Vlastne celá táto "operácia" enzýmu je synchronizovaný pohyb nízkoenergetických interakcii. V princípe aj celkový život organizmu a bunky samotnej je len chémia slabých interakcii. Keď poznáme silové pôsobenie týchto interakcií môžeme na základe toho napísať algoritmus, podľa ktorého bude počítač pracovať na simulácii. Potom sa do programu nahádžu priami a nepriami aktéri (DNA, enzýmy, voda, iónové zloženie karyoplazmy...). Na výstupe môžeme sledovať krok po kroku celú "policajnú operáciu" týchto enzýmov. Zistime odpovede na vyššie položené otázky,a tieto odpovede zas môžeme použiť pri vývoji liekov. Dúfam, že si uvedomujete, že tento proces je náročný na výkon počítača a od jeho rýchlosti závisí ako rýchlo budeme mať výsledky. Za predpokladu, že máme dobrý algoritmus.
To nie sme len pri reparácii, má všeobecné využitie. Takto môžeme simulovať mnohé procesy v bunkách. Katabolické, anabolické, prenos informácii signálnymi molekulami, transportné mechanizmy v membránach a iné. Dokážeme študovať následnosť krokov v reakcii a spôsob pohybu molekúl. Alebo môžeme vytvoriť vlastný proteín, molekulu (liek?), ktorej účinok môžeme ľahšie a presnejšie pozorovať. Dopredu vieme, či sme na dobrej ceste alebo nie. Všetko závisí od postupnosti a správnosti algoritmu a výkonu počítača, či dostaneme správe výsledky v rozumnom čase. Potrebujeme k tomu digitalizovať molekuly a na základe slabých interakcií atómov poskladať nejaký systém. Tých molekúl a systémov nie je zanedbateľný počet

Proteíny sa sťahujú k nám domov
Teraz prejdem k tomu ako aj Vy môžete pri tomto pomôcť a byť priamo zapojený vo výskume. V súčastnosti potrebujeme v prvom rade poznať tvar a funkcie proteínov, to zistíme na základe primárnej štruktúry, ktorá sa premietne do konečnej priestorovej a stabilnej terciárnej/kvartérnej štruktúry. Človek pozná funkcie len obmedzeného množstva proteínov. Ale dokážeme si pomocou DNA proteín nasyntetizovať a pomocou známych interakcií nasimulovať tvar, teda aj virtuálne študovať ich funkciu a neskôr aj správanie sa v konkrétnych podmienkach za konkrétnej situácie. Vyrieši to problém, že pri podmienkach in vivo a in vitro je to veľmi obtiažné a prakticky nemožné priamo pozorovať chemické reakcie a presný tvar polymérov. Na druhej strane na nasimulovanie nejakého proteínu potrebujeme veľký počítačový výkon, to sme znova pri klasickom probléme: nedostatok financií na vytváranie a prevácku superpočítačov. Navyše k tomu, obtiažnosť simulácie geometricky narastá s veľkosťou proteínu, počtom AK v reťazci a veľkosťou systému. Čiže kde budeme simulovať? Na akých počítačoch? Je to síce beh na dlhé trate, ale musíme niekde niekde začať a vyštartovať aby sme podbehli bližšie k vytúženému cieľu.
Čo je prvoradou úlohou Rosetty? Zaoberá sa foldingom (modelovaním) proteínov do terciárnej štruktúry a spájaním podjednotiek do kvartérnej štruktúry spôsobom opísaním v prvej časti článku. Ako východiskové údaje stačia atómy nachádzajúce sa v reťazci AK, ostatné je len matematika väzieb. Vďaka bohu, že energiu každej konformácie nemusíme počítať ručne, na to máme projekty podobné Rosette. Takže celkovým modelovaním proteínu sa snažíme nájsť najstabilnejšiu možnú konformáciu na základe náhodného ohýbania reťazca a vyhodnocovaním energetického stavu. Inými slovami povedané stav s čo najnižšou vnútornou energiou. Teda po skončení budeme mať pred sebou proteín vhodný na ďalšie spracovanie a študovanie vedcami, ktorým takto pomôžeme dostať zhluk atómov do reálno-virtuálnej viditeľnej podoby. Už nie sú odkázaný na schematické pozorovania "priamo" "neviditeľného" proteínu v skúmavke. Dá sa aj simulovať vzťah k nejakým iónom (Zn2+) ako kofaktorom alebo aktivátorom enzýmu. Navyše Rosetta počtárom vizuálne ukáže screen, kde je ukázaná štruktúra pre ktorú sa v tom momente počíta energetický stav. Názorné ukážky:
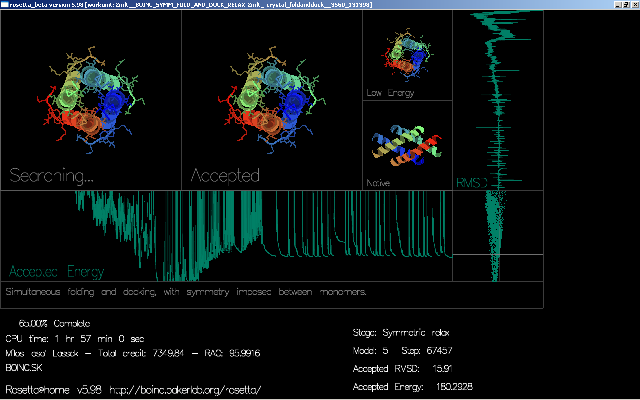
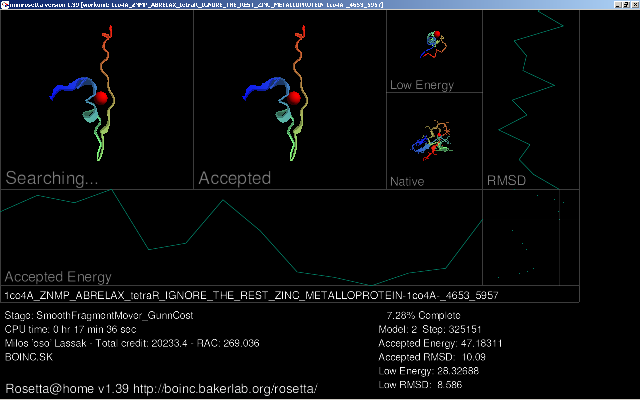
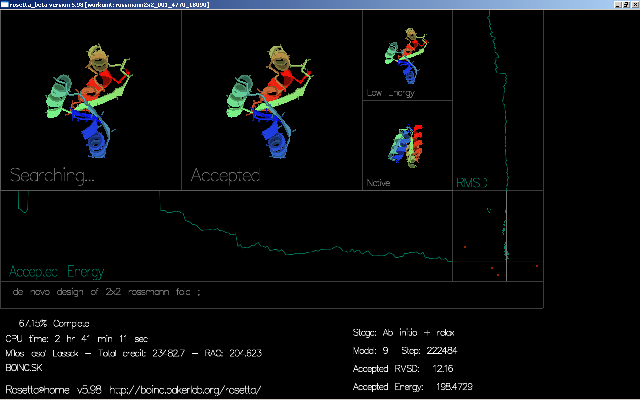
Program nie je dokonalý, však ho písal človek, ale rosetta sa stále zdokonaľuje čo značne urýchľuje a tvorí korektné výsledky. Aj preto sa berú do úvahy konformácie vytvorené viacerými programami. Po tomto procese je hotový proteín uložený do databanky, voľne prístupnej vedcom, vlastne aj nám. A celkový výkon? U Rosetty to činí 86 TeraFLOPS a systém BOINC produkuje 1,3 PetaFLOPS, teda 1 300 TeraFLOPS (26. 01. 2009). Nasimulované proteíny, ktoré sa zúčasnili súťaže CASP8 sú prístupne Tu, tam môžete pozrieť aktuálne nasimulované proteíny (nielen Rosetty ale aj iných techník a spôsobov modelovania).
© by OŠO, Miloš Laššák
- Ak chcete pridať komentáre, tak sa musíte prihlásiť
- prečítané 53160x
-
- Zobraziť stránkované


